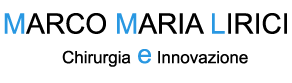Linfadenectomia in chirurgia colorettale
Il cancro colorettale è al secondo posto per incidenza e mortalità neoplastica nella popolazione italiana. I dati stimati dal Reparto Epidemiologia dei Tumori del Centro Nazionale di Epidemiologia Sorveglianza e Promozione della Salute dell’Istituto Superiore di Sanità riportano una incidenza di 46.963 nuovi casi e una mortalità di 15.820 casi per l’anno 2007, con un tasso grezzo di incidenza per 100.000 abitanti di 101,02 per gli uomini e 67,8 9 per le donne e una prevalenza globale di 286.209 malati. I dati sono in continua crescita come dimostra la progressione dall’inizio degli anni ’90 (incidenza di circa 30.000 nuovi casi anno) alle ultime stime 2008 della stessa fonte che riportano per il 2008 una incidenza, una mortalità e una prevalenza rispettiv amente di 47.612 nuovi casi, 15.631 decessi, 295.457 malati.
La chirurgia rimane il trattamento cardine per la cura del cancro colorettale. Le sopravvivenze dopo chirurgia sono strettamente correlate allo stadio della malattia e i risultati migliorano, nei tumori con linfonodi positivi per infiltrazione neoplastica, con la associazione della chemioterapia postoperatoria [1,2]. Il ruolo della linfadenectomia, la sua estensione, la analisi dei linfonodi sono pertanto essenziali sia per la corretta stadiazione del tumore che per selezionare i pazienti da indirizzare verso trattamenti adiuvanti[1,2]. Mentre è chiaro il ruolo rivestito dalla chemioterapia nei pazienti con metastasi linfonodali, rimane imprecisato quello nei casi con linfonodi apparentemente liberi. Un terzo di questi pazienti, difatti, sviluppa delle recidive. Tuttavia, terapie adiuvanti a scopo preventivo in tutti i casi con linfonodi privi di malattia esporrebbero ad una chemioterapia non necessaria il 70% di questi pazienti in cui la chirurgia da sola risulterebbe, di per sé, curativa[2].
Una tecnica di resezione oncologicamente corretta influisce sui risultati della chirurgia per cancro del colon retto. Nelle linee guida 2000 del National Cancer Institute sulle tecniche di resezione oncologica del colon - retto tracciate sulla base del livello di evidenza della letteratura corrente specificandone il grado di raccomandazione, risultano avere evidenza consistente (grado di raccomandazione B) 7 fattori: definizione anatomica (colon vs. retto), stadiazione TNM adeguata, margini radiali, resezione R0, perforazione accidentale del retto, margini rettali prossimale e distale, resezione en-bloc con tumori adiacenti. Minore consistenza (grado C di raccomandazione) per altri 7 fattori: approccio laparoscopico alla chirurgia del colon, linfadenectomia nel cancro del colon, sezione centrale dei vasi, escissione completa del mesoretto, linfadenectomia laterale pelvica estesa (questi 3 nel cancro del retto), no-touch technique, washout intestinale [3].
E’ comunque vero che la adeguatezza della linfadenectomia durante resezione colorettale, una raccolta e la analisi di un numero sufficiente di linfonodi sono risultati fattore prognostico essenziale nei pazienti allo stadio II (TNM) della malattia (Dukes B) dove è provato che un numero di linfonodi analizzati inferiore a 8, ma da molti Autori il cut-off è stato spostato a 12, 15 e persino 20 linfonodi, si associa ad una sopravvivenza a 5 anni sovrapponibile a quella dello stadio III (Dukes C, N1 secondo la classificazione TNM) [1,4-7]. Altrettanto importante è risultato essere il ruolo della escissione totale del mesoretto per le sopravvivenze a distanza nel carcinoma rettale primitivo del terzo medio ed inferiore[8,9].
Alla luce di queste considerazioni, in tema di linfadenectomia tre sono le componenti che devono essere analizzate per valutarne l’impatto su prognosi e risultati della chirurgia per cancro colorettale:
1. la tecnica chirurgica con particolare riguardo alla estensione della linfadenectomia per garantire un numero adeguato di linfonodi presenti nel pezzo operatorio, e come debba essere condotto correttamente l’intervento qualora l’approccio di scelta sia il laparoscopico, approccio che, per quanto concerne le neoplasie coliche, i trial randomizzati completati nell’ultimo decennio hanno mostrato essere preferibile se non altro in termine di qualità di vita postoperatoria[10];
2. la tecnica di campionamento e di analisi dei linfonodi presenti nel pezzo operatorio con l’eguale intento di garantire un esame su un numero di linfonodi sufficiente e sufficientemente accurato in particolare per i tumori allo stadio II (Dukes B);
3. l’importanza delle micrometastasi linfonodali e dell’impianto linfonodale di cellule tumorali isolate (ITC) che, se misconosciute/i, potrebbero essere alla base delle recidive nei casi di neoplasia con linfonodi negativi (da considerarsi in questo caso dei falsi negativi) e il ruolo del mapping linfatico mediante analisi focalizzata del/i linfonodo/i sentinella per il loro riconoscimento, permettendo conseguentemente una stadiazione corretta della malattia (upstaging)[2,11-14].
Tecnica chirurgica
La linfadenectomia radicale seguendo le linee della vascolarizzazione arteriosa è fondamentale per una dissezione sistematica linfonodale e per rimuovere tutti i linfonodi potenzialmente metastatici[15]. Gli standard oncologici della chirurgia curativa del cancro colorettale si basano teoricamente su 4 principi: dissezione en-bloc, tecnica no-touch di isolamento del segmento da resecare, legatura centrale dei vasi e linfadenectomia sistematica[15]. Per assicurare una linfadenectomia adeguata le resezioni colorettali per cancro devono rispettare, quindi, il principio delle legature vascolari centrali e preliminari, mentre la loro estensione dipende dalla localizzazione del tumore primitivo [16]. Nel cancro del ceco e del colon ascendente prossimale è necessaria la sezione dei vasi ileocolici, colici destri all’origine e ramo destro della arteria colica media alla sua origine. Neoplasie dell’ascendente distale, flessura destra e tumori entro i 10 cm. dalla flessura epatica richiedono la legatura all’origine dei vasi ileocolici, colici destri e della colica media, con esecuzione di una colectomia destra allargata[17]. Neoplasie maligne del colon discendente e sigma richiedono una colectomia sinistra con linfadenectomia adeguata assicurata dalla legatura di vena mesenterica inferiore al di sotto del margine inferiore del pancreas, della arteria mesenterica inferiore alla sua origine, in modo da asportare tutto il ventaglio di mesocolon sinistro e mesosigma, con sezione distale del viscere al di sotto del promontorio per assicurare una sufficiente irrorazione. Tumori della flessura splenica o del trasverso distale (entro i 10 cm dalla flessura) devono essere trattati mediante colectomia sinistra allargata con sezione all’origine dei vasi colici sinistri e medi [17]. Tumori del terzo medio del traverso richiedono la resezione trasversaria completa con legatura all’origine dei vasi colici medi. 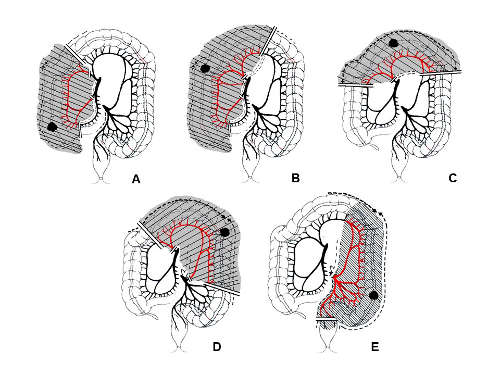
Cartouche raffiguranti la estensione delle resezioni coliche per una raccolta adeguata dei linfonodi loco-regionali: A colectomia destra, B colectomia destra allargata al traverso, C resezione di traverso, D colectomia sinistra allargata al traverso, E colectomia sinistra, F resezione anteriore del retto con TME.
I margini di resezione devono cadere almeno a 10 cm dalla neoplasia su entrambi i versanti, in modo da mantenere al di sotto del 5% il rischio di mancata rimozione di linfonodi metastatici paracolici[16]. La legatura centrale dei vasi è motivata dal fatto che in almeno il 10% dei casi i linfonodi risultano coinvolti a questo livello[16].
Nel cancro del retto la sezione vascolare ricalca quella del discendente distale e del sigma, con legatura della vena mesenterica inferiore al di sotto del margine inferiore del pancreas, previa dissezione del Treitz, e dell’arteria mesenterica inferiore all’origine.
La importanza della legatura alta dell’arteria mesenterica inferiore è tutt’ora controversa [16]. E’ stato dimostrato indispensabile per il conseguimento di una linfadenectomia adeguata la escissione totale del mesoretto [8,9,15]. Alcuni Autori riportano benefici in termine di sopravvivenze a 5 anni negli stadi II e III associando una linfadenectomia pelvica estesa (D3) [8,18]. La dissezione linfonodale estesa è stata avocata anche per le neoplasie del sigma ma in entrambe i casi il dato rimane controverso [3,8,18]. Altrettanto controversa è l’importanza della tecnica di dissezione no-touch, in quanto se, da una parte, Autori riportano sopravvivenze maggiori del 6% adottando questa tecnica [16], non vi è evidenza che una tecnica di isolamento colorettale convenzionale comporti un distacco e una diffusione a distanza di cellule neoplastiche messe in circolo durante le manovre chirurgiche.
Cellule neoplastiche non risultano, infatti, identificabili, nonostante la sua alta sensibilità, dalla metodica analitica RT-PCR (Reazione a Catena Transcriptasi Inversa-Polimerasi) [19]. Estremamente importante la esecuzione di una resezione en-bloc nel caso di organi adiacenti infiltrati: la loro separazione, seppure involontaria, favorisce la contaminazione con cellule neoplastiche e può portare ad una riduzione della aspettativa di vita a 5 anni anche fino al 40% [3,16].
L’approccio laparoscopico alla chirurgia oncologica del colon è stato studiato in quattro trial randomizzati di fase III (Barcelona, COSTSG, COLOR, CLASICC) [10,20,21]. Uno di questi studi valuta anche i risultati della laparoscopia nel cancro del retto (CLASICC) [10]. Nessuna differenza significativa è stata riportata in termini di estensione della linfadenectomia e numero di linfonodi raccolti in confronto alla chirurgia open [20,21,22].
La tecnica da noi eseguita nell’approccio laparoscopico alle resezioni colorettali per cancro rispetta i principi menzionati: tecnica no-touch, resezioni en-bloc in caso di neoplasie limitrofe, sezioni preliminari e centrali dei vasi. La dissezione lungo gli assi vascolari viene portata avanti mediante dissettore ad Ultrasuoni (US). Sia le vene che le arterie vengono sezionate tra clip riassorbibili, preferite alle suturatici endolineari per evitare la compressione del tessuto linfograsso perivasale con possibile squeezing di linfonodi eventualmente presenti. La preparazione dei vasi arteriosi all’origine viene preferibilmente eseguita per via sottoavventiziale;
Sezione sottoavventiziale tra clip riassorbibili di arteria mesenterica inferiore all’origine, mediante dissettore ad US.
ciò permette di allungare il vaso stesso e garantisce la completezza della dissezione linfonodale centrale. Nelle colectomie destre dopo sezione dei vasi ileocolici all’origine, si segue l’asse della arteria mesenterica superiore sino a incontrare, se esistenti, i vasi colici destri e quindi i vasi colici medi. A sinistra si preferisce legare preventivamente la vena mesenterica inferiore; la arteria viene approcciata successivamente tenendo in trazione il mesosigma con una pinza di Babcock a livello della plica di Grüber e aprendo il peritoneo al di sopra della arteria iliaca destra e portando la dissezione in direzione cefalica. Completato il tempo vascolare, la dissezione prosegue lungo il piano anatomico di clivaggio tra fascia di Toldt e Gerota sia a destra che a sinistra sempre mediante impiego di US, ma soprattutto per via smussa. La visione magnificata del laparoscopio consente di eseguire questo tempo con elevata precisione esercitando un trauma minimo sui mesi. Nelle resezioni anteriori del retto in cui si associa sempre la escissione totale del mesoretto, la dissezione lungo il piano di Heald viene eseguita per lo più per via smussa o mediante US. La dissezione anteriore e dei legamenti laterali viene eseguita sempre mediante US. La sezione bassa del retto è facilitata notevolmente, una volta completata la dissezione del mesoretto e dopo adeguata preparazione del cilindro rettale a livello del piano degli elevatori, mediante applicazione della nuova suturatrice curvilinea Contour. Questa si adatta più facilmente alla conformazione anatomica della pelvi e consente la contemporanea sutura e sezione del viscere.
Esame macroscopico di pezzo operatorio dopo sigmoidectomia.
Nonostante sia disegnata per la chirurgia open può essere impiegata in laparoscopia assicurando il mantenimento dello pneumoperitoneo mediante un dispositivo di protezione della parete su anello (Steri-drape) o un dispositivo per chirurgia hand-assisted [23].
Campionamento ed analisi dei linfonodi
La classificazione TNM per il carcinoma del colon - retto offre la possibilità di ottenere maggiori informazioni rispetto ad altri tipi di stadiazione; se comparata infatti con la stadiazione di Dukes, essa permette di identificare più agevolmente i diversi sottogruppi prognostici [24]. La valutazione dello stato linfonodale è parte integrante della classificazione TNM, al momento il determinante maggiore per la terapia adiuvante e, come già detto, fattore prognostico per il carcinoma del colon - retto. La ricerca di un adeguato numero di linfonodi riduce il rischio di perdere focolai metastatici linfonodali e consente una più accurata stadiazione del paziente. Per la valutazione del parametro N della classificazione TNM deve quindi essere indagato il maggior numero possibile di linfonodi loco-regionali, perché la presenza o assenza di metastasi linfonodali rimane il fattore prognostico più importante nel carcinoma del colon - retto. I linfonodi regionali sono localizzati lungo il decorso dei grossi vasi che irrorano il colon ed il retto; lungo le arcate vascolari delle ramificazioni arteriose e a ridosso della parete colica, all’inserzione del meso. Secondo la classificazione TNM vengono considerati linfonodi regionali quelli pericolici e perirettali e quelli reperiti lungo le arterie ileo-colica, colica di destra, colica media, colica sinistra mesenterica inferiore, rettale superiore e le iliache interne. Il numero di linfonodi reperiti nelle linfadenectomie da chirurgia radicale del colon - retto appare molto variabile nelle differenti casistiche e questa variabilità può dipendere da molteplici fattori, quali la quantità di tessuto adiposo periviscerale, il numero di linfonodi effettivamente asportati, l’accuratezza della linfadenectomia e l’esito di eventuali terapie neoadiuvanti. Al momento del campionamento per l’esame istologico, posto che la linfadenectomia sia stata adeguata, la pazienza, l’accuratezza e l’esperienza del patologo nella ricerca dei linfonodi loco-regionali appaiono quindi fondamentali.
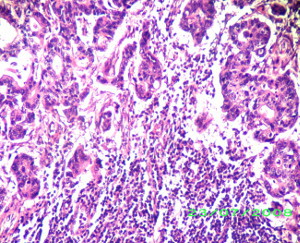
Metastasi linfonodale: nel contesto del tessuto linfoide si riconoscono strutture ghiandolari neoplastiche di adenocarcinoma moderatamente differenziato.
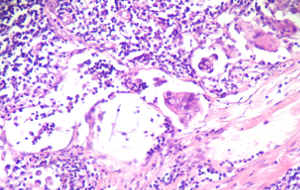
Micrometastasi linfonodale: in sede sobcapsulare, nel contesto del tessuto linfonodale, si evidenza un gruppo di cellule neoplastiche.
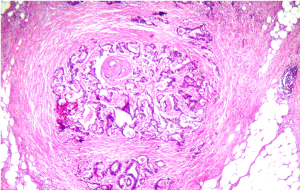
Nodulo neoplastico: nodulo di tessuto neoplastico nel grasso pericolico, a contorni regolari ed espnasivi, riferibile a linfonodo completamente sostituito.
Nella nostra esperienza, la ricerca dei linfonodi loco-regionali al momento del campionamento su materiale da chirurgia radicale del colon-retto, si basa principalmente sulla dissezione manuale dei linfonodi, seguendo il decorso dei grossi vasi e delle loro ramificazioni e lungo l’inserzione del meso. La ricerca viene eseguita palpatoriamente, individuando e dissecando delicatamente i linfonodi dall’albero vascolare e dalla parete intestinale. Il numero di linfonodi reperiti deve essere superiore a 12. Talvolta tale numero può non essere raggiunto, neanche dopo l’esame microscopico del materiale prelevato; in tali casi si può disidratare progressivamente il tessuto meso-colico residuo in una miscela di alcol ed acetone, per reperire eventuali linfonodi sfuggiti alla prima dissezione standard [25]. Tale procedura è comunque indaginosa, dispendiosa di tempo e di materiali e di scarsa efficacia se la dissezione standard è stata accurata; può essere, però, utilizzata in casi particolari, p.es. dopo una terapia neoadiuvante, situazione nella quale il numero di linfonodi è in effetti drasticamente ridotto in esito alla terapia. Vengono sottoposti all’esame istologico tutti i linfonodi macroscopicamente negativi; essi devono essere inclusi interamente. I linfonodi macroscopicamente metastatici posso essere esaminati anche soltanto in parte, al solo scopo di confermare la presenza di metastasi [26]. Vengono inoltre prelevati tutti i noduli neoplastici reperiti nel tessuto adiposo pericolico; l’evidenza istologica di una residua rima di tessuto linfoide o la regolarità dei contorni consentono di assegnare questi noduli alla categoria N. L’esame istologico dei linfonodi reperiti prevede la colorazione di routine in ematossilina/eosina. Attualmente non ci sono dati sufficienti sul significato biologico delle micrometastasi e delle ITC, pertanto la loro ricerca con metodiche aggiuntive, quali differenti livelli di sezione, indagini immunoistochimiche e RT-PCR è riservata allo studio del linfonodo sentinella.
Mapping linfatico e linfonodo sentinella
Il razionale per la esecuzione della ricerca del linfonodo sentinella (che si ricorda potrebbe essere un cluster linfonodale) mediante mapping linfatico nelle resezioni colorettali per cancro risiede nel fatto che le metodiche istopatologiche convenzionali per l’esame dei linfonodi, anche in caso di linfadenectomie tecnicamente adeguate, hanno specifiche limitazioni, portando in alcuni casi ad una sottostadiazione della malattia. Il 70% dei linfonodi in un preparato chirurgico di colon o retto ha un diametro inferiore ai 0,5 cm, potendo sfuggire all’esame macroscopico facilmente e portando ad una scorretta valutazione dell’N qualora fossero presenti dei piccoli focolai metastatici [2]. Del resto, anche se nel tempo sono state proposte metodiche analitiche più sofisticate per evidenziare le micrometastasi quali il multilevel-step sectioning, l’immunoistochimica per la cheratina (CK-IHC) e la reazione a catena transcriptasi inversa-polimerasi (RT-PCR), queste risultano indaginose, lunghe e spesso proibitive per costi [2].La finalità della ricerca del linfonodo sentinella è, dunque, concettualmente diversa nel cancro del colon retto rispetto a quello mammario: una sua sistematica ricerca è in funzione di aumentare il numero di linfonodi da esaminare e, soprattutto, evidenziare focolai micrometastatici che possano sfuggire alle normali metodiche di analisi e non di evitare una linfadenectomia inutile. Sono diversi i lavori presenti in letteratura in questo campo, tuttavia la percentuale di successi nel rilevare focolai micrometastatici nel linfonodo sentinella varia fra il 58 e il 100%, con percentuale di focolai sfuggiti alle metodiche tradizionali assai variabile, avendo un range tra il 3 e il 60%[2].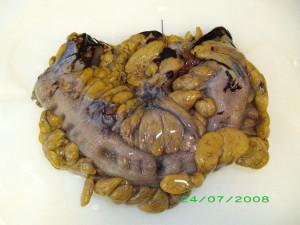
Esame macroscopico di pezzo operatorio dopo sigmoidectomia.
La tecnica prevede la identificazione della neoplasia primitiva, quindi la iniezione circonferenziale attorno ad essa, dopo mobilizzazione viscerale senza dissezione linfatica e vascolare, di 0,5-1 mL del colorante blu di isosolfano; al colorante tissutale blu può essere associato del radiocolloide [2,12]. Entro sessanta secondi si inizia a visualizzare l’afferente linfatico che viene dissecato sino a raggiungere i primi 1-3 linfonodi cos
ì colorati che vengono marcati con un repere. Il canale linfatico afferente viene poi seguito in direzione prossimale (verso la neoplasia primitiva) per assicurarsi che non siano rimasti dei linfonodi misconosciuti nel grasso pericolico. La resezione colorettale, a questo punto, può procedere come di routine. La tecnica può essere eseguita sia durante resezioni a cielo aperto che laparoscopiche [27]. Spesso nelle neoplasie del retto, il mapping linfatico per la identificazione del linfonodo sentinella viene eseguito ex-vivo, una volta resecato il pezzo [2,27]. La analisi prevede la sezione e processazione del preparato entro le 4 ore dalla raccolta per minimizzare il movimento di colorante verso i linfonodi non sentinella. Il tessuto del linfonodo sentinella viene in parte congelato al criostato e quindi sezionato, in parte incluso in paraffina. Sezioni multiple vengono eseguite per colorazione con ematossilina-eosina, per analisi molecolare e per esame immunoistochimico per citocheratina (CK-IHC) [2].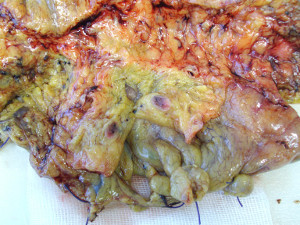
Esame macroscopico del colon con linfonodi: sezione di tessuto adiposo pericolico, nel quale si evidenzia un linfonodo patologico
Discussione
Tutti i trials randomizzati sulle colectomie laparoscopiche versus open per cancro hanno in maniera consistente dimostrato la riduzione del dolore postoperatorio e della ospedalizzazione e un più precoce recupero delle funzioni intestinali e ritorno ad una dieta normale nel braccio laparoscopico [10]. Lo studio di Barcelona sembra indicare un significativo miglioramento delle sopravvivenze a 5 anni nello stadio III per il braccio laparoscopico [10]. L’approccio laparoscopico non rappresenta un ostacolo alla corretta linfadenectomia ed è stata provata la fattibilità della ricerca del linfonodo sentinella durante interventi laparoscopici [20,21,27]. Anche se è stata dimostrata la sicurezza della tecnica laparoscopica in chirurgia colorettale, non è stato risolto ancora il problema della adeguatezza della linfadenectomia sia durante interventi open che laparoscopici: esiste una forte discrepanza nel numero di linfonodi raccolti ed esaminati nelle varie casistiche e, spesso, questi numeri non raggiungono il minimo richiesto dalle principali linee guida [3,24].Inoltre, la stessa grande variabilità che esiste nelle differenti casistiche, relativa al numero dei linfonodi loco-regionali reperiti, non consente di stabilire con sufficiente certezza il numero di linfonodi necessari per validare una diagnosi N0 [28]. Nella nostra esperienza, anche in considerazione delle linee guida AJCC 2005, il numero minimo di linfonodi reperiti deve essere pari a 12 e pertanto ogni qualvolta tale numero non venga raggiunto, è raccomandato il ricorso a metodiche di ricerca più approfondite. E’ da tenere presente che tale numero, da altri Autori, è ritenuto insufficiente e che in teoria si dovrebbe sempre puntare in ogni caso esaminato al più alto numero di linfonodi possibili da reperire, cercando di raggiungere il numero minimo solo in quei casi che, ad una prima analisi, abbiano portato ad una raccolta insufficiente di linfonodi. Una stretta collaborazione tra chirurgo e patologo favorisce il reperimento di un numero adeguato di linfonodi loco-regionali. Questa considerazione deriva non solo dalla nostra esperienza ma dalla analisi dei trial finalizzati a valutare estensione della linfadenectomia e numero di linfonodi necessari per una stadiazione ottimale del cancro colorettale: tutti gli Autori riferiscono un aumento progressivo e significativo del numero di linfonodi reperiti ed analizzati durante il corso degli studi clinici [1,4,5,17,29,30]!
Esistono tre variabili da tener presente quando si considera il numero di linfonodi raccolti e analizzati dopo resezioni colorettali per cancro: il chirurgo, l’anatomopatologo ed il paziente. E’ accettato diffusamente che la presenza linfonodale nei foglietti mesenterici possa variare da individuo ad individuo [5]. Questa variabile, tuttavia, qualora la tecnica di resezione sia adeguata e altrettanto quella di raccolta ed analisi dei linfonodi da parte del patologo, non ha impatto sulla prognosi: il numero minore di linfonodi è espressione esclusiva della variabilità individuale e non inficia la correttezza della stadiazione. Le altre due variabili, al contrario, impattano fortemente sulla prognosi del malato di cancro colorettale, in particolare nei casi di malattia classificata allo stadio II. Il fattore chirurgo è chiaramente rilevante ma lo è anche la tipologia e la funzione della istituzione dove il chirurgo opera: nel 2003 Smith ha dimostrato, ad esempio, che il numero di linfonodi raccolti dopo interventi “didattici” è drammaticamente superiore alla media, grazie anche al coinvolgimento del patologo nella attività formativa [31]. E’ interessante notare che anche il fattore tumore ha una sua valenza sul numero di linfonodi reperiti in un pezzo operatorio: in uno studio del 2005 basato sulla popolazione sia lo stadio che il grado di T è stato messo in correlazione con il numero di linfonodi, risultando sempre significativamente più elevato negli stadi più avanzati e con l’aumentare di T (livello di infiltrazione radiale) [29]. Nello stesso studio anche la localizzazione del tumore rivestiva importanza, essendo quasi doppio il numero di linfonodi dopo colectomia destra rispetto ad una resezione per neoplasie del colon sinistro o del retto [29]. Anche la lunghezza del pezzo operatorio dopo colectomia destra risultava maggiore di quella del pezzo dopo resezioni sinistre. Tale dato fa a taluni ritenere che il numero minimo di linfonodi da analizzare per una corretta stadiazione dell’N dopo colectomia destra dovrebbe essere maggiore, ma su questo ultimo punto non vi è uniformità di dati e di vedute. La lunghezza del pezzo asportato è, in ogni caso, proporzionale al numero di linfonodi reperiti. Nello stesso studio basato sulla popolazione (una analisi di 116.995 interventi eseguiti tra il 1988 e il 2001) anche l’età del paziente e il periodo storico in cui la resezione colorettale era stata effettuata sono risultate variabili significative: pazienti di età inferiore ai 50 anni avevano una maggiore probabilità di andare incontro ad una linfadenectomia e ad uno studio adeguato dei linfonodi rispetto a quelli di età superiore ai 71 anni. Più interessante osservare come nei casi operati nel 1988 solo il 32% aveva ricevuto una stadiazione linfonodale ”adeguata”, rispetto al 44% dei pazienti operati nel 2001. Questo dato testimonia la importanza delle linee guida per una corretta tecnica di resezione e di stadiazione del cancro colorettale.
L’esame dei risultati della esperienza dell’Autore conferma quanto detto: lì dove ci si attiene a protocolli di reperimento e di analisi dei linfonodi, collaborando strettamente con il chirurgo, la percentuale di adeguatezza della linfadenectomia risulta molto elevata, superando significativamente i dati medi riportati in letteratura. L’impossibilità di attenersi rigidamente ai protocolli, spesso anche per situazioni locali contingenti (carenza di mezzi o personale) fa cadere drammaticamente le percentuali di adeguatezza della linfadenectomia. La maggiore collaborazione tra chirurgo e patologo porta però anche in queste situazioni a un miglioramento significativo dei risultati, come si evince dal confronto dei dati relativi al II e al III periodo della casistica esaminata. Il rischio da tener presente è sempre quello di una possibile sottostadiazione dei pazienti dallo stadio III al II. Nella nostra esperienza non esistono differenze significative nella raccolta di linfonodi dopo colectomie destre e sinistre, mentre l’approccio laparoscopico si è sempre dimostrato oncologicamente valido con un numero di linfonodi asportati sempre superiore a quello dopo resezioni open
Il ruolo della ricerca del linfonodo sentinella è controverso, in particolare la sua pratica routinaria. La tecnica può essere valutata guardandola come metodica per ottenere l’upstaging della malattia da N0 ad N+: questo è risultato avvenire in circa il 15% dei malati allo stadio II, portati così allo stadio III e indirizzati verso trattamenti adiuvanti [32]. In un trial multicentrico grazie proprio a questa potenzialità si è avuta la riduzione delle recidive a 2 anni nel braccio di pazienti con cancro del colon sottoposti a mapping linfonodale rispetto al braccio con pazienti sottoposti a stadiazione convenzionale: nei primi l’incidenza di recidive è risultata essere del 7% contro il 25% dei secondi [11]. Più difficile valutare l’efficacia del mapping linfatico nella identificazione di linfonodi positivi al di fuori dell’area linfatica loco-regionale standard, e probabilmente meno interessante sul piano pratico la possibilità che questa metodica possa sostituire nel tempo la tecnica convenzionale di stadiazione [11] Una metanalisi uscita nel 2007 riporta i risultati dei 17 articoli più rilevanti su studi riguardanti il mapping linfatico nel carcinoma colorettale [12]. In 15 di questi studi la ricerca veniva effettuata con iniezione peritumorale di colorante tissutale, negli altri due veniva associato al colorante tissutale il radiocolloide. L’identificazione del linfonodo sentinella è riportata tra il 71 e il 100% dei casi, con una accuratezza variabile dal 78 al 100% e una sensibilità tra il 25 e il 100%. Il dato più importante è quello riguardante la percentuale di upstaging grazie al mapping linfatico e questa varia dallo 0 al 26% [12]. L’associazione del colorante tissutale con il radiocolloide non comporta alcun beneficio particolare. Da questi risultati si deduce che a tutt’oggi la ricerca del linfonodo sentinella mediante mapping linfatico intraoperatorio o ex-vivo per il cancro colorettale rimane procedura sperimentale che però può offrire significativi vantaggi nella malattia altrimenti classificata allo stadio II. Rimane sempre la considerazione sui costi e benefici del mapping linfonodale: i nostri dati evidenziano che, qualora ci si attenga a rigidi protocolli di exeresi chirurgica e di analisi del preparato, l’adeguatezza della linfadenectomia è tale da minimizzare il rischio di una stadiazione erronea nei casi classificati N0. il ruolo di metodiche potenzialmente time-consuming e che comportano un deciso aumento dei costi deve pertanto essere ulteriormente e attentamente valutato ricorrendo a trial randomizzati multicentrici più estesi.
Bibliografia
1. Prandi M, Lionetto R, Bini A, Francioni G, Accarpio G, Anfossi A, Ballario E, Becchi G, Bonilauri S, Carobbi A, Cavaliere P, Garcea D, Giuliani L, Morziani E, Mosca F, Mussa A, Pasqualini M, Poddie D, Tonetti F, Zardo L, Rosso R. Prognostic evaluation of stage B colon cancer patients is improved by an adeguate lymphadenectomy: results of a secondary analysis of a large scale adjuvant trial. Ann Surg 2002; 235:458-63
2. Bilchik AJ, DiNome M, Saha S, Turner RR, Wiese D, McCarter M, Hoon DSB, Morton DL. Prospective multicenter trial of staging adequacy in colon cancer. Preliminary results. Arch Surg 2006; 141:527-34
3. Nelson H, Petrelli N, Carlin A, Couture J, Fleshman J, Guillem J, Miedema B, Ota D, Sargent D. Guidelines 2000 for colon and rectal cancer surgery. JNCI Journal of the National Cancer Institute 2002; 93: 583-96
4. Cianchi F, Palomba A, Boddi V, Tesserini L, Pucciani F, Perigli G, Bechi P, Cortesini C. Lymph node recovery from colorectal tumor specimens: recommendation for a minimum number of lymph nodes to be examined. World J Surg 2002; 26: 384-89
5. Wong JH, Bowles BJ, Bueno R, Shimizu D. Impact of the number of negative nodes on disease-free survival in colorectal cancer patients. Dis Colon Rectum 2002; 45:1341-8
6. Le Voyer TE, Sigurdson ER, Hanlon AL, Mayer RJ, Macdonald JS, Catalano PJ, Haller DG. Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of Intergroup Trial INT-0089. J Clin Oncol 2003; 21: 2912-9
- 7. Chen S, Bilchick AJ. More extensive nodal dissection improves survival for stage I to III of colon cancer: a population based study. Ann Surg 2006; 244:602-10
8. Havenga K, Enker W, Norstein J, Moriya Y, Heald R, van Houwelingen H, van de Velde C. Improved survival and local control after total mesorectal excision or D3 lymphadenectomy in the treatment of primary rectal cancer: an international analysis of 1411 patients. European J Surgical Oncology 2003; 25: 368-74
9. Leroy J, Jamali F, Forbes L, Smith M, Rubino F, Mutter D, Marescaux J. Laparoscopic total mesorectal excision (TME) for rectal cancer surgery. Long-term outcomes. Surg Endosc 2004; 18: 281-9
10. Boller AM, Nelson H. Colon and rectal cancer: laparoscopic or open? Clinical Cancer Research 2007; 13: 6894s-6896s
11. Pocard M, Van den Eynde M, Goere D, Boige V, Malka D. Sentinel lymph node sampling and analysis in colon cancer: what is the question? J Clin Oncol 2006; 24: 3712-3
12. De Haas R, Wicherts DA, Hobbelink MGG, Borel Rinkes IHM, Schipper MEI, van der Zee JA, van Hillegersberg R. Sentinel lymph node mapping in colon cancer: current status. Annals of Surgical Oncology 2007; 14: 1070-80
13. Stojadinovic A, Nissan A, Protic M, Adair CF, Prus D, Usaj S, Howard RS, Radovanovic D, Breberina M, Shriver CD, Grinbaum R, Nelson JM, Brown TA, Freund HR, Potter JF, Peretz T, Peoples GE. Prospective randomized study comparing sentinel lymph node evaluation with standard pathologic evaluation for the staging of colon carcinoma: results from the United States Military Cancer Institute Clinical Trial Group Study GI-01. Ann Surg 2007; 245:846-57
14. Redston M, Compton CC, Miedema BW, et al. Analysis of micrometastatic disease in sentinel lymph nodes from resectable colon cancer : results of Cancer and Leukemia Group B Trial 80001. J Clin Oncol 2006; 24: 878-83
15. Bruch HP, Schwandner O, Schiedeck THK, Roblick UJ. Actual standards and controversies on operative technique and lymph-node dissection in colorectal cancer. Langenbeck’s Arch Surg. 1999; 384:167-75
16. Maurer CA. Colon cancer: resection standards. Techniques in Coloproctology 2004 ; 8 : s29-s32
17. Lee YS, Lee IK, Kang WK, Cho HM, Park JK, Oh ST, Kim JG, Kim YH. Surgical and pathological outcomes of laparoscopic surgery for transverse colon cancer. Int J Colorectal Dis 2008; 23:669-673
18. Liang JT, Huang KC, Lai HS, Lee PH, Sun CT. Oncologic results of laparoscopic D3 lymphadenectomy for male sigmoid and upper rectal cancer with clinically positive lymph nodes. Annal of Surgical Oncology 2007; 14: 1980-1990
19. Garcia-Olmo D, Ontanon J, Garcia-Olmo D, Vallejo M, Cifuentes J. Experimental evidence does not support use of the no-touch isolation technique in colorectal cancer. Dis Colon Rectum 1999; 42: 1449-55
20. Veldkamp R, Gholghesai M, Bonjer HJ, Meijer DH, Buunen M, Jeekel J, Anderberg B, Cuesta MA, Cuschieri A, Fingerhut A, Fleshman JW, Guillou PJ, Haglind E, Himpens J, Jacobi CA, Jakimowicz JJ, Koeckerling F, Lacy AM, Lezoche E, Monson JR, Morino M, Neugebauer E, Wexner SD, Whelan RL. Laparoscopic resection for colon cancer. Consensus of the European Association of Endoscopic Surgery (EAES). Surg Endosc 2004; 18:1163-85
21. Veldkamp R, Gholghesai M, Bonjer HJ, Meijer DH, Buunen M, Jeekel J, Anderberg B, Cuesta MA, Cuschieri A, Fingerhut A, Fleshman JW, Guillou PJ, Haglind E, Himpens J, Jacobi CA, Jakimowicz JJ, Koeckerling F, Lacy AM, Lezoche E, Monson JR, Morino M, Neugebauer E, Wexner SD, Whelan RL. Colonic cancer update 2006 in: EAES Guidelines for Endoscopic Surgery, Neugebauer EAM, Sauerland S, Fingerhut A, Millat B, Buess G Eds. Springer Verlag Berlin Heidelberg New York 2006: 209-12
22. Hasegawa H, Kabeshima Y, Watanabe M, Yamamoto S, Kitajima M. Randomized controlled trial of laparoscopic versus open colectomy for advanced colorectal cancer. Surg Endosc 2003; 17: 636-40
23. Lirici MM, Califano A. Low section of the rectum using the Contour device: an alternative technique. Surg Endosc 2008; 22: 263-4
24. American Joint Committee on Cancer. AJCC Cancer Staging Handbook 6th edition. Springer Verlag Berlin New York Heidelberg 2002: 127-138
25. Brown HG, Luckasevic TD, Medich DS, Celebrezze JP, Jones SM. Efficacy of manual dissection of limph nodes in colon cancer resections. Modern Pathology 2004; 17: 402-406
26. Goldstein NS. Lymph node recoveries from 2427 pT3 colorectal resection specimens spanning 45 years: recommendations for a minimum number of recovered lymphnodes based on predictive probabilities. Am J Surg Pathol 2002; 26: 79-189
27. Wood TF, Saha S, Morton DL, Tsioulias Gj, Rangel D, Hutchinson Jr W, Foshag LJ, Bilchik AJ. Validation of lymphatic mapping in colorectal cancer: in vivo, ex vivo, and laparoscopic techniques. Annals of Surgical Oncology 2001; 8: 150-7
28. Mammen JM, James LE, Molloy M, Williams A, Wray CJ, Sussman JJ. The relationship of lymph node dissection and colon cancer survival in the Veterans Affair Central Cancer Registry. Am J Surg 2007 Sep 194 (3) : 349-354
29. Baxter NN, Virnig DJ, Rothenberger DA, Morris AM, Jessurun J, Virnig BA. Lymph node evaluation in colorectal cancer patients: a population-based study. JNCI Journal of the National Cancer Institute 2005; 97: 219-25
30. Jass JR, O’Brien MJ, Riddell RH, Snover DC, Association of Directors of Anatomic and Surgical Pathology. Recommendations for the reporting of surgically resected specimens of colorectal carcinoma. Hum Pathol 2007; 38: 537-45
31.Smith AJ, Law CH, Khalifa MA, Hsieh ET, Hanna SS, Wright FC. Multimodal CME for surgeons and pathologist improves colon cancer staging. J Cancer Educ 2003; 18: 81-6
32. Saha S, Seghal R, Patel M, et al. A multicenter trial of sentinel lymph node mapping in colorectal cancer: prognostic indications for nodal staging and recurrence. Am J Surg 2006; 191:305-10